- porady
- technologia
- często zadawane pytania
- testy
- pojemność mAh
- pojemność znamionowa
- everActive
- porównanie
- trwałość akumulatorków
- efektywność akumulatorków
- napięcie akumulatorka
- skumulowana energia
- baterie vs akumulatorki
- LR03 AAA
- LR6 AA
- eneloop
- AG13 LR1154 LR44
- delta v
- cykle ładowania
- rezystancja wewnętrzna
- stopień naładowania
- CR 2032
- efekt pamięci
- badanie akredytowane
- SR44 357
- baterie słuchowe 675
- SR626 377
- baterie zegarkowe
- polaryzacja
- mAh
- pasywacja
- ls 14250
- ls 14500
Jak działa bateria?
2019-06-19
Wewnątrz baterii zachodzi reakcja wytwarzająca wolne elektrony. Prędkość z jaką w wyniku tej reakcji uwalniane są elektrony (wewnętrzna rezystancja - opór - baterii) ogranicza rzecz jasna liczbę elektronów które mogą przepłynąć pomiędzy biegunami. Elektrony muszą przepływać z baterii przez przewód i obciążenie, od ujemnego do dodatniego bieguna, aby zachodziła reakcja chemiczna która uwolni ich jeszcze więcej. Z tego powodu możemy pozostawić nieużywaną baterię na półce np. przez rok, po czym dalej eksploatować ją bez żadnych problemów - dopóki elektrony nie przepływają od ujemnego do dodatniego bieguna, reakcja chemiczna nie zachodzi. W momencie w którym bieguny zostaną połączone - reakcja się rozpoczyna.
Reakcje chemiczne w bateriach
Jedną z najprostszych baterii jest bateria cynkowo-węglowa. Przyglądając się zachodzącym w jej wnętrzu reakcjom możemy łatwiej zrozumieć ogólną zasadę działania wszystkich baterii. Wyobraźmy sobie, że mamy słoik kwasu siarkowego (H2SO4). Jeżeli umieścimy w nim cynkowy pręt, żrący kwas natychmiast zacznie go rozpuszczać. Zobaczymy bąbelki wodoru zbierające się na powierzchni cynku, i zarówno pręt jak i kwas zaczną się nagrzewać.Oto co się dzieje:
- cząsteczki kwasu rozpadają się na trzy jony: dwa jony H+ i jeden jon SO4--
- atomy cynku na powierzchni prętu tracą dwa elektrony (2e-) i stają się jonami Zn++
- jony Zn++ łączą się z jonami SO4-- tworząc ZnSO4, który rozpuszcza się w kwasie
- elektrony z atomów cynku łączą się z jonami H+ i tworzą cząsteczki H2 (wodoru gazowego)
- elektrony zaczną przemieszczać się wzdłuż przewodu i łączyć się z wodorem na pręcie węglowym, z którego teraz także zaczną wydzielać się pęcherzyki wodoru
- wydzielanie ciepła znacznie się zmniejszy; używając elektryczności płynącej teraz przewodem, moglibyśmy np. zasilić żarówkę - i zmierzyć powstałe napięcie i prąd płynący przez przewód - część energii cieplnej została zamieniona na ruch elektronów.
Na tej samej zasadzie działają baterie które znamy. Różnią się one typami użytych metali i elektrolitów, jednakże wszystkie działają dzięki temu samemu zjawisku - elektronom płynącym z jednego bieguna do drugiego. W zależności od użytych składników, zmienia się także napięcie charakterystyczne takiej baterii. Prześledźmy to na przykładzie typowego ołowiowego akumulatora samochodowego:
- akumulator zawiera jedną płytę wykonaną z ołowiu i drugą - z dwutlenku ołowiu, obie zanurzone w elektrolicie z silnie stężonego kwasu siarkowego
- ołów łączy się z SO4 tworząc PbSO4 i jeden wolny elektron
- dwutlenek ołowiu, jony wodoru i jony SO4, oraz elektrony z płyty ołowiowej, tworzą PbSO4 i wodę na płycie z dwutlenku ołowiu w miarę upływu czasu, obie płyty pokrywają się PbSO4, a woda miesza się z kwasem; napięcie charakterystyczne wynosi ok. 2V - zatem, łącząc szeregowo 6 ogniw, otrzymujemy baterię ogniw o napięciu 12V
- baterie cynkowo-węglowe - tak popularne, że zwane niekiedy "zwykłymi"; to najczęściej używane baterie, w takich rozmiarach jak R6/AA, R14/C, R20/D; elektrody są tu wykonane z cynku i
- węgla, z pastą kwasową umieszczoną między nimi, służącą jako elektrolit
- baterie alkaliczne - ich elektrody wykonane są z cynku i tlenku manganu, z zasadowym elektrolitem
- baterie litowe - wykorzystują lit, jodek litu lub jodek ołowiu; używane są najczęściej w aparatach fotograficznych, ze względu na to, że są w stanie dostarczać energii w krótkich, dużych porcjach (wymagane do zasilania lamp błyskowych)
- baterie cynkowo powietrzne - używane do zasilania aparatów słuchowych.
- akumulatory kwasowo-ołowiowe - używane w samochodach; elektrody wykonane są z ołowiu i tlenku ołowiu, z silnie stężonym kwasem w charakterze elektrolitu
- akumulatory niklowo-kadmowe (Ni-Cd) - elektrody wykonane są z wodorotlenku niklu oraz kadmu, z wodorotlenkiem potasu w charakterze elektrolitu
- akumulatory niklowo-wodorkowe (Ni-MH) - szybko zastąpiły akumulatory niklowo-kadmowe w większości zastosowań w związku z brakiem "efektu pamięciowego", przypisywanego akumulatorkom Ni-Cd
- akumulatory litowo-jonowe - z doskonałym stosunkiem pojemności do wagi, najczęściej używane w laptopach i telefonach komórkowych.
Łączenie ogniw / baterii
We wcześniejszych rozważaniach używaliśmy słów "bateria" i "ogniwo" zamiennie. Jest to zgodne z tendencją panującą w języku potocznym. Jednakże z punktu widzenia technicznego, słowa "bateria" i "ogniwo" mają całkiem różne znaczenia. I tak "ogniwo" oznacza pojedyncze źródło zasilania, np. takie jak opisany na początku słoik z kwasem i dwa pręty połączone przewodem (lub np. "paluszek" R6/AA). "Bateria" natomiast to zespół połączonych ogniw (jak np. bateria 3R12, składająca się z trzech ogniw w jednej obudowie, połączonych szeregowo). W takim właśnie znaczeniu używać będziemy tych dwóch określeń w dalszej części tego tekstu.W większości urządzeń raczej nie używamy pojedynczego ogniwa. Zamiast tego, łączymy ich kilka - bądź to szeregowo, dla uzyskania wyższego napięcia, bądź równolegle - dla uzyskania wyższych prądów. W połączeniu szeregowym uzyskujemy sumę napięć połączonych ogniw; w połączeniu równoległym - sumę prądów uzyskiwanych z ogniw składowych.
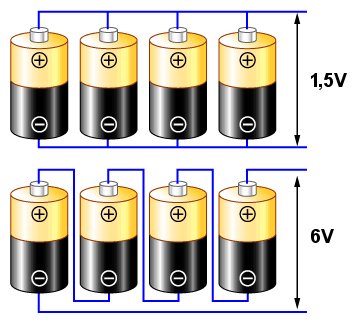
Połączenie jak na górnym schemacie nazywane jest równoległym. Jeżeli założymy, że każde z ogniw ma napięcie charakterystyczne 1,5V (jak typowe pojedyncze ogniwo cynkowo-węglowe lub alkaliczne), to uzyskane na końcowych zaciskach (wskazanych strzałkami) napięcie będzie wynosiło nadal 1,5V, jednak uzyskany prąd będzie miał cztery razy wyższe natężenie niż ten który uzyskalibyśmy z pojedynczego ogniwa.
Połączenie jak na schemacie dolnym nazywamy szeregowym. W tym wypadku, sumują się napięcia z poszczególnych ogniw, dając napięcie 6V między zaciskami.
Kupując baterię lub ogniwo, na opakowaniu można zazwyczaj przeczytać, jakie jest jej napięcie - czasem także pojemność. Na przykład, typowe akumulatorki używane w kamerach cyfrowych posiadają napięcie 1,2V i pojemność 2000mAh. Pojemność 2000mAh (mAh to skrót od miliamperogodziny) oznacza że, teoretycznie, akumulatorek taki jest w stanie dostarczać prądu o natężeniu 2000mA (2000 miliamperów, czyli 2 ampery) przez godzinę, prądu o natężeniu 1A przez dwie godziny, prądu o natężeniu 100mA przez 20 godzin, itd. Jednakże, ogniwa zazwyczaj wcale nie zachowują się tak liniowo. Po pierwsze, każda bateria ma określone maksymalne natężenie prądu którego jest zdolna dostarczyć. I tak, akumulatorek 500mAh wcale nie będzie w stanie dostarczyć prądu o natężeniu 30A przez sekundę, ponieważ nie ma sposobu żeby zachodzące we wnętrzu akumulatorka reakcje chemiczne dostarczyły tylu elektronów w tak krótkim czasie. Po drugie, przy dużych prądach, ogniwa zazwyczaj mocno się rozgrzewają, co marnuje sporo ich energii. Po trzecie - wiele systemów chemicznych używanych w bateriach działa krócej (lub dłużej!) przy bardzo niskich poborach prądu. Mimo wszystko jednak, pojemność mierzona w amperogodzinach daje nienajgorsze pojęcie o tym, jak długo wytrzyma dane ogniwo przy określonym poborze prądu, w typowych warunkach eksploatacyjnych.
Copyright © Baltrade
Dodaj komentarz